Giải Hóa 9 Bài 7: Tính chất hóa học của Bazơ – VnDoc.com
Giải Hóa 9 Bài 7: Tính chất hóa học của Bazơ được VnDoc sưu tầm và đăng tải. Với lời giải chi tiết rõ ràng giúp các bạn học sinh nắm chắc được những kiến thức căn bản của bài học để hiểu rõ về các tính chất hóa học và phương trình phản ứng của Bazơ.
A. Tóm tắt lý thuyết Hóa 9 bài 7 Tính chất hóa học của Bazơ
1. Phân loại Bazo
Bazơ tan: LiOH, KOH, NaOH, Ba(OH)2, Ca(OH)2
Bazơ không tan: Al(OH)3, Zn(OH)2, Fe(OH)2, Fe(OH)2, Cu(OH)2
2. Tính chất hóa học của Bazo
Bazơ tan (dung dịch kiềm)Bazơ không tanLàm đổi màu chất chỉ thị
+ Đổi màu quỳ tím thành xanh
+ Dung dịch phenolphtalein không màu thành màu hồng
Tác dụng với oxit axit2NaOH + CO2 → Na2CO3 + H2OTác dụng với axit
Cả bazơ tan và không tan đều phản ứng.
Tạo thành muối và nước
HCl + NaOH → NaCl + H2O2HCl + Cu(OH)2 → CuCl2 + 2H2ONhiệt phânBazơ không tan bị nhiệt phân.
Tạo thành oxit tương ứng và nước.
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Tác dụng với muốiĐược học trong bài 9
B. Giải bài tập Hóa 9 bài 7 sách giáo khoa
Bài 1 Trang 25 SGK Hóa 9
a) Có phải tất cả các chất kiềm đều là bazơ không? Dẫn ra công thức hóa học của ba chất để kiềm để minh họa.
b) Có phải tất cả các bazơ đều là chất kiềm không? Dẫn ra công thức hóa học của ba chất để kiềm để minh họa.
Đáp án hướng dẫn giải bài tập
a) Vì kiềm là một loại bazơ tan được trong nước nên tất cả các chất kiềm đều là bazơ.
Thí dụ: NaOH, KOH, Ba(OH)2.
b) Vì không phải mọi bazơ đều tan trong nước nên không phải tất cả các bazơ đều là chất kiềm.
Thí dụ: Các bazơ Cu(OH)2, Mg(OH)2, Fe(OH)3… không phải là chất kiềm.
Bài 2 Trang 25 SGK Hóa 9
Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào
a) Tác dụng được với với dung dịch HCl.
b) Bị nhiệt phân hủy.
c) Tác dụng được CO2.
d) Đổi màu quỳ tím thành xanh.
Đáp án hướng dẫn giải bài tập
a) Tất cả các bazơ đều tác dụng với axit HCl:
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
b) Chỉ có Cu(OH)2 là bazơ không tan nên bị nhiệt phân hủy:
Cu(OH)2 → CuO + H2O
c) Những bazơ tác dụng với CO2 là NaOH và Ba(OH)2.
2NaOH + CO2 → Na2CO3 + H2O
Ba(OH)2 + CO2 → BaCO3 + H2O
d) Những bazơ đổi màu quỳ tím thành màu xanh là NaOH và Ba(OH)2.
Bài 3 Trang 25 SGK Hóa 9
Từ những chất có sẵn là Na2O, CaO, H2O. Hãy viết các phương trình hóa học điều chế các dung dịch bazơ.
Đáp án hướng dẫn giải bài tập
Phương trình hóa học điều chế các dung dịch bazơ:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Bài 4 Trang 25 SGK Hóa 9
Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH, Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết các phương trình hóa học.
Đáp án hướng dẫn giải bài tập
Lấy từ mỗi lọ một mẫu hóa chất (gọi là mẫu thử) để làm thí nghiệm nhận biết.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
Những dung dịch làm quỳ tím đổi màu là: NaOH và Ba(OH)2, (nhóm 1).
Những dung dịch không làm quỳ tím đổi màu là: NaCl, Na2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là Na2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng: Ba(OH)2 + Na2SO4 → BaSO4 + NaOH
Hoặc các em xem theo sơ đồ hướng dẫn sau
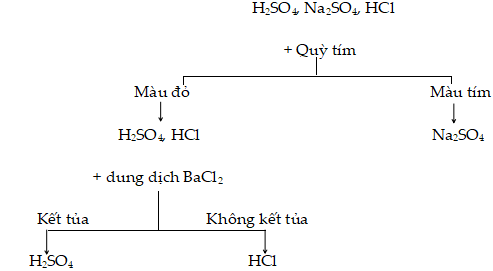
Bài 5 Trang 25 SGK Hóa 9
Cho 15,5 gam natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Đáp án hướng dẫn giải bài tập
Số mol Na2O = 15,5 : 62 = 0,25 mol
a) Khi cho Na2O xảy ra phản ứng, tạo thành phản ứng dung dịch có chất tan là NaOH.
Phương trình hóa học
Na2O + H2O → 2NaOH
0,25 → 0,5 (mol)
500 ml = 500/1000= 0,5 lít;
CM NaOH = 0,5/0,5 = 1M.
b) Phương trình phản ứng trung hòa dung dịch:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Pứ 0,5 → 0,25 0,25 (mol)
mH2SO4 = 0,25 . 98 = 24,5 g
mdd H2SO4 = 24,5.100/20= 122,5 g
mdd, ml = mdd,g = Dg/ml = 122,5/1,14 ≈ 107,5 ml
C. Giải bài tập sách bài tập Hóa 9 bài 7 Tính chất hóa học của bazơ
Ngoài các dạng bài tập luyện tập trong sách giáo khoa Hóa 9 bài 7, các bạn học sinhc ó thể bổ sung hoàn thành các dạng bài tập sách bài tập, với đầy đủ nhiều các dạng bài tập hơn. Từ đó có thể củng cố nâng cao khả năng giải luyện bài tập. Để giúp các bạn thuận tiện trong quá trình học tập giải bài tập VnDoc đã biên soạn hướng dẫn giải chi tiết bài tập sách bài tập tại:
- Giải bài tập sách bài tập Hóa 9 bài 7 Tính chất hóa học của bazo
D. Trắc nghiệm Hóa 9 bài 7: Tính chất hóa học của bazơ
Câu 1: Dung dịch làm quỳ tím chuyển thành màu xanh là:
A. HNO3
B. KCl
C. Ca(OH)2
D. Na2SO4
Câu 2: Chỉ dùng nước có thể nhận biết chất rắn nào trong 4 chất rắn sau đây:
A. Cu(OH)2
B. Fe(OH)2
C. KOH
D. Al(OH)3
Câu 3: Chất khí sẽ không bị giữ lại khi cho qua dung dịch Ca(OH)2 là:
A. CO2
B. N2
C. SO2
D. Cả A, B và C
Câu 4: Dung dịch NaOH phản ứng với dãy oxit:
A. CO2; SO2; P2O5; Fe2O3
B. Fe2O3; SO2; SO3; MgO
C. P2O5; CO2; Al2O3; SO3
D. P2O5; CO2; CuO; SO3
Câu 5: Dãy các bazơ bị nhiệt phân huỷ tạo thành oxit bazơ tương ứng và nước:
A. Cu(OH)2; Zn(OH)2; Al(OH)3; Fe(OH)3
B. Cu(OH)2; Mg(OH)2; Fe(OH)3; KOH
C. Fe(OH)3; Cu(OH)2; KOH; Zn(OH)2
D. Fe(OH)3; Zn(OH)2; Ca(OH)2; Mg(OH)2
Câu 6: Để nhận biết dd NaOH và dd Ba(OH)2 ta dùng thuốc thử là:
A. Phenolphtalein
B. Quỳ tím
C. dung dịch H2SO4
D. dung dịch HCl
Câu 7. Dãy các bazo làm phenolphtalein hóa đỏ
A. NaOH; Ca(OH)2; Zn(OH)2; Mg(OH)2
B. NaOH; Ca(OH)2; KOH; Ba(OH)2
C. NaOH; Ba(OH)2; KOH; Al(OH)3
D. NaOH; Ba(OH)2; Ca(OH)2; Fe(OH)3
Câu 8. Dãy các bazơ bị phân hủy ở nhiệt độ cao:
A. Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3.
B. Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2.
C. Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2.
D. Zn(OH)2, Ca(OH)2, KOH, NaOH.
Câu 9. Thuốc thử để nhận biết dung dịch Ca(OH)2 là:
A. Na2CO3
B. KCl
C. NaOH
D. NaNO3
Câu 10. Dung dịch NaOH không có tính chất nào sau đây?
A. Làm đổi màu quỳ tím và phenophtalein
B. Bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước
C. Tác dụng với oxit axit tạo thành muối và nước
D. Tác dụng với axit tạo thành muối và nước
Câu 11. Cặp oxit phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ là:
A. H2O Fe2O3.
B. Al2O3, CuO.
C. Na2O, K2O.
D. ZnO, H2O.
Câu 12. Dung dịch có pH > 7 là
A. HCl
B. NaCl
C. NaOH
D. CuSO4
Đáp án câu hỏi trắc nghiệm
1 C2C3B4C5A6C7 B8 C9A10B11C12C
Để có thể nâng cao, mở rộng các dạng bài tập hơn nữa, VnDoc biên soạn bộ câu hỏi 20 câu dưới hình thức trắc nghiệm, giúp các bạn học sinh làm quen với nhiều dạng câu hỏi hơn, từ đó quen với các hình thức câu hỏi. Mời các bạn tham khảo tại: Trắc nghiệm Hóa học 9 bài 7
…………………………….
Giải Hóa 9 Bài 7: Tính chất hóa học của Bazơ. Trên đây VnDoc đã hướng dẫn các bạn trả lời các câu hỏi nằm trong SGK môn lớp 9, nắm chắc một số Tính chất hóa học của Bazơ từ đó vận dụng vào giải các các bài tập Hóa học lớp 9. Mời các bạn cùng tham khảo chuẩn bị cho bài học sắp tới. Từ đó vận dụng giải các dạng bài tập hóa học, trong sách giáo khoa cũng như sách bài tập. Sau đây mời các bạn cùng tham khảo.
Mời các bạn tham khảo thêm một số tài liệu liên quan:
- Giải Hóa 9 bài 16: Tính chất hóa học của kim loại
- Giải Hóa 9 Bài 12: Mối quan hệ giữa các loại chất vô cơ
- Giải bài tập trang 36 SGK Hóa lớp 9: Một số muối quan trọng
- Giải bài tập SGK Hóa học lớp 9 bài 14: Thực hành: Tính chất hóa học của bazơ và muối
- Giải bài tập trang 39 SGK Hóa lớp 9: Phân bón hóa học
- Đề cương ôn tập học kì 1 môn Hóa học phần bài tập lớp 9
- Hóa học lớp 9: Nhận biết – Phân biệt các chất
Trên đây VnDoc đã đưa tới các bạn bộ tài liệu rất hữu ích Giải Hóa 9 Bài 7: Tính chất hóa học của Bazơ. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Chuyên đề Toán 9, Chuyên đề Vật Lí 9, Lý thuyết Sinh học 9, Giải bài tập Hóa học 9, Tài liệu học tập lớp 9 mà VnDoc tổng hợp và đăng tải.
Theo dõi chúng tôi www.hql-neu.edu.vn để có thêm nhiều thông tin bổ ích nhé!!!

