Nếu dựa và hiệu độ âm điện thì liên kết cộng hóa trị không cực (cặp electron chung không lệch về phía nguyên tử nào) từ 0,0 đến <0,4 còn liên kết cộng hóa trị có cực (cặp electron chung lệch về phía nguyên tử có độ âm điện lớn hơn) có hiệu độ âm điện từ 0,4 đến <1,7.
I. Liên kết cộng hóa trị – Kiến thức cần nhớ
– Để làm bài tập về liên kết cộng hóa trị, các em có thể tham khảo bài viết đầy đủ: Liên kết cộng hóa trị là gì? liên kết cộng hóa trị có cực và không cực
– Dưới đây là một số nội dung chính để vận dụng làm bài tập liên kết cộng hóa trị mà các em cần nhớ:
Loại liên kết
Liên kết cộng hóa trị
Không cực
Có cực
Định nghĩa
Liên kết cộng hóa trị là liên kết được tạo nên giữa hai nguyên tử bằng 1 hay nhiều cặp electron chung
Bản chất của liên kết
Cặp e chung không lệch về phía nguyên tử nào
Cặp e chung lệch về phía nguyên tử có độ âm điện lớn hơn
Hiệu độ âm điện
từ 0 đến < 0,4
từ 0,4 đến < 1,7
– Dấu hiệu nhận biết liên kết cộng hóa trị là: Phân tử đơn chất và hợp chất được hình thành từ phi kim.
* Ví dụ: Liên kết giữa các nguyên tử giống nhau (đơn chất) và các nguyên tử khác nhau (hợp chất) sau: O2, H2, N2, F2, F2O, HF, H2O,…
II. Bài tập về liên kết cộng hóa trị có lời giải
* Bài 1 trang 64 SGK Hóa 10: Chọn câu đúng nhất về liên kết cộng hóa trị. Liên kết cộng hóa trị là liên kết
A. Giữa các phi kim với nhau.
B. Trong đó cặp electron chung bị lệch về một nguyên tử.
C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau.
D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
° Lời giảiL
– Đáp án đúng: D. Được tạo nên giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
* Bài 2 trang 64 SGK Hóa 10: Chọn câu đúng trong các câu sau:
A. Trong liên kết cộng hóa trị cặp electron lệch về phía nguyên tử có độ âm điện nhỏ hơn.
B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
C. Liên kết cộng hóa trị không có cực được tạo nên từ các nguyên tử khác hẳn nhau về tính chất hóa học.
D. Hiệu độ âm điện giữa 2 nguyên tử lớn thì phân tử phân cực yếu.
° Lời giải:
– Đáp án đúng: B. Liên kết cộng hóa trị có cực được tạo thành giữa 2 nguyên tử có hiệu độ âm điện từ 0,4 đến nhỏ hơn 1,7.
* Bài 3 trang 64 SGK Hóa 10: Độ âm điện của một nguyên tử đặc trưng cho
A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
B. Khả năng nhường electron của nguyên tử đó cho nguyên tử khác.
C. Khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó.
D. Khả năng nhường proton của nguyên tử đó cho nguyên tử khác.
Chọn đáp án đúng.
° Lời giải:
– Đáp án đúng: A. Khả năng hút electron của nguyên tử đó khi hình thành liên kết hóa học.
* Bài 4 trang 64 SGK Hóa 10: Thế nào là liên kết ion, liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực, liên kết cộng hóa trị có cực. Cho thí dụ minh họa.
° Lời giải:
– Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện trái dấu. Thí dụ : K+ + Cl- → KCl.
– Liên kết cộng hóa trị không cực là liên kết được tạo nên giữa hai nguyên tử bằng những cặp electron chung. Thí dụ: Cl. + .Cl → Cl:Cl
– Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực. Thí dụ: H. + .Cl → H :Cl hay H -Cl.
* Bài 5 trang 64 SGK Hóa 10: Dựa vào hiệu độ âm điện các nguyên tố, hãy cho biết có loại liên kết nào trong các chất sau đậy: AlCl3, CaCl2, CaS, Al2S3? (Lấy giá trị độ âm điện của các nguyên tố ở bảng 6 trang 45).
° Lời giải:
– Hiệu độ âm điện:
CaCl2: 2,16. Liên kết ion
AlCl3: 1,55. Liên kết cộng hóa trị có cực
CaS: 1,58.Liên kết cộng hóa trị có cực.
Al2S3: 0,97. Liên kết cộng hóa trị có cực.
* Bài 6 trang 64 SGK Hóa 10: Viết công thức electron và công thức cấu tạo các phân tử sau: Cl2, CH4, C2H2, C2H4,NH4.
° Lời giải:
– Công thức electron và công thức cấu tạo các phân tử sau:
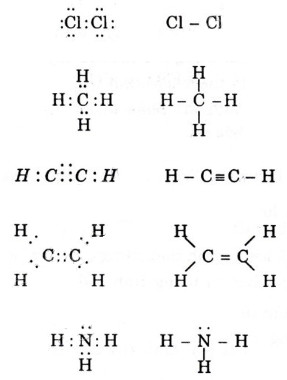
* Bài 7 trang 64 SGK Hóa 10: X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và Z, Z và X.
° Lời giải:
a) 9X : 1s22s22p5 Đây là F có độ âm điện là 3,98.
19A : 1s22s22p63s23p64s1 Đây là K có độ âm điện là 0,82.
8Z: 1s22s22p4 Đây là O có độ âm điện là 3,44.
b) Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16, có liên kết ion.
– Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62, có liên kết ion.
– Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, có liên kết cộng hóa trị có cực.
III. Bài tập về liên kết cộng hóa trị có đáp án
* Bài tập 1: Cho X, A, Z là những nguyên tố có số điện tích hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên tử của các nguyên tố đó.
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A; A và Z; Z và X.
* Hướng dẫn:
a) Viết cấu hình electron nguyên tử của các nguyên tố:
9X: 1s22s22p5: Là nguyên tố F có độ âm điện (tra bảng độ âm điện) là 3,98
19A: 1s22s22p63s23p64s1 : Là nguyên tố K có độ âm điện là 0,82
9Z: 1s22s22p4: Là nguyên tố O có độ âm điện là 3,44
b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A; A và Z; Z và X
– Cặp X và A, hiệu số độ âm điện là: 3,98 – 0,82 = 3,16 → có liên kết ion.
– Cặp A và Z, hiệu số độ âm điện là: 3,44 – 0,82 = 2,62 → có liên kết ion.
– Cặp X và Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54 → có liên kết cộng hóa trị có cực.
* Bài tập 2: Cho các phân tử N2, HCl, NaCl, MgO. Các phân tử đều có liên kết cộng hóa trị là
A. N2 và HCl
B. HCl và MgO
C. N2 và NaCl
D. NaCl và MgO
* Hướng dẫn:
– Đáp án: A: N2 và HCl
– Còn NaCl và MgO là liên kết ion
* Bài tập 3: Dãy phân tử nào cho dưới đây đều có liên kết cộng hoá trị không phân cực?
A. N2, Cl2, H2, HCl
B. N2, Cl2, H2, CO2
C. N2, Cl2, CH4, HI
D. Cl2, F2, O2, N2
* Hướng dẫn:
– Đáp án: D: Cl2, F2, O2, N2
