Phản ứng FeCl2 + NaOH → Fe(OH)2↓trắng xanh + NaCl
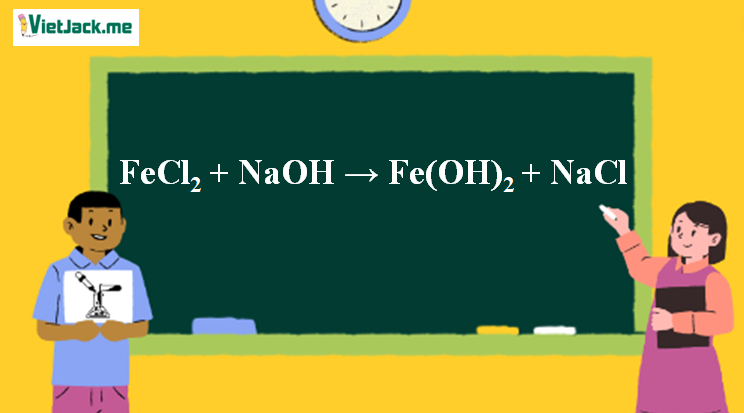
1. Phương trình phản ứng FeCl2 ra Fe(OH)2
2. Viết phương trình ion thu gọn của FeCl2+ NaOH
Phương trình phân tử của FeCl2+ NaOH:
FeCl2 + 2NaOH → Fe(OH)2↓trắng xanh + 2NaCl
Phương trình ion rút gọn:
Fe2+ + 2OH− → Fe(OH)2↓trắng xanh
3. Điều kiện xảy ra phương trình phản ứng NaOH + FeCl2
Nhiệt độ phòng
4. Hiện tượng phản ứng xảy ra khi cho FeCl2 tác dụng với NaOH
Cho dung dịch FeCl2 tác dụng với dd NaOH, sau phản ứng thu được tạo thành kết tủa trắng xanh kém bền.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của FeCl2 (Sắt (II) clorua)
FeCl2 là muối tác dụng được với dung dịch kiềm.
5.2. Bản chất của NaOH (Natri hidroxit)
NaOH là một bazo mạnh phản ứng với muối tạo muối mới và bazo mới.
6. Tính chất hoá học của NaOH
6.1. Làm đổi màu chất chỉ thị
Dung dịch NaOH làm quỳ tím chuyển thành màu xanh.
Dung dịch NaOH làm phenolphthalein không màu chuyển sang màu đỏ, đổi màu methyl da cam thành màu vàng.
6.2. Tác dụng với oxit axit
Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Phản ứng với oxit axit: NO2, SO2, CO2…
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
NaOH + SO2→ NaHSO3
2NaOH + 2NO2→ H2O + NaNO2 + NaNO3 (tạo 2 muối )
NaOH + CO2 → NaHCO3
2NaOH + CO2→ Na2CO3 + H2O
3NaOH + P2O5 → Na3PO4↓ + 3H2O
NaOH + SiO2 → Na2SiO3
Phản ứng với SiO2 là phản ứng ăn mòn thủy tinh vì thế khi nấu chảy NaOH, người ta dùng các dụng cụ bằng sắt, niken hay bạc mà không dùng thủy tinh để chứa NaOH.
6.3. Tác dụng với axit
Là một bazơ mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hòa.
Ví dụ:
NaOH + HCl → NaCl+ H2O
NaOH + HNO3→ NaNO3+ H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
3NaOH + H3PO4→ Na3PO4 + 3H2O
2NaOH + H2CO3 → Na2CO3 + 2H2O
6.4. Tác dụng với muối
Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazơ mới.
Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2⏐↓
NaOH + MgSO4→ Mg(OH)2 + Na2SO4
2NaOH + MgCl2 → 2NaCl + Mg(OH)2
FeCl3 + 3NaOH → Fe(OH)3+ 3NaCl
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓ nâu đỏ
6.5. Tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOH nóng chảy → 2Na + 2Na2CO3 + 3H2↑
4P trắng + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
Cl2+ 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → NaCl + NaClO3 + 3H2O
6.6. Hoà tan một hợp chất của kim loại lưỡng tính Al, Zn, Be Sn Pb
Ví dụ: Al, Al2O3, Al(OH)3
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3→ 2NaAlO2 + H2O
NaOH + Al(OH)3→ NaAlO2 + 2H2O
Chất được tạo ra trong dung dịch có thể chứa ion Na[Al(OH)4], hoặc có thể viết
Al(OH)3 + NaOH → Na[Al(OH)4]
Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng.
7. Mở rộng kiến thức về FeCl2
7.1. Tính chất vật lí và nhận biết
– Tính chất vật lý: Nó là một chất rắn thuận từ có nhiệt độ nóng chảy cao, và thường thu được dưới dạng chất rắn màu trắng. Tinh thể dạng khan có màu trắng hoặc xám; dạng ngậm nước FeCl2.4H2O có màu xanh nhạt. Trong không khí, dễ bị chảy rữa và bị oxi hoá thành sắt (III).
– Nhận biết: Sử dụng dung dịch AgNO3, thấy xuất hiện kết tủa trắng.
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl↓
7.2. Tính chất hóa học
– Mang đầy đủ tính chất hóa học của muối.
– Có tính khử Fe2+ → Fe3+ + 1e
a) Tính chất hóa học của muối:
– Tác dụng với dung dịch kiềm:
FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
– Tác dụng với muối
FeCl2 + 2AgNO3 → Fe(NO3)2 + 2AgCl
b) Tính khử:
Thể hiện tính khử khi tác dụng với các chất oxi hóa mạnh:
2FeCl2 + Cl2 → 2FeCl3
7.3. Điều chế
– Cho kim loại Fe tác dụng với axit HCl:
Fe + 2HCl → FeCl2 + H2
– Cho sắt (II) oxit tác dụng với HCl
FeO + 2HCl → FeCl2 + H2O
8. Câu hỏi trắc nghiệm liên quan
Câu 1. Chia bột kim loại A thành 2 phần. Phần một cho tác dụng với Cl2 tạo ra muối B. Phần 2 cho tác dụng với dung dịch HCl tạo ra muối C. Cho kim loại X tác dụng với muối B lại thu được muối C. Vậy A là kim loại nào sau đây?
A. Cu
B. Al
C. Zn
D. Fe
Lời giải:
Câu 2. Cho các dung dịch sau: HCl, Na2CO3, AgNO3, Na2SO4, NaOH và KHSO4. Số dung dịch tác dụng được với dung dịch Fe(NO3)2 là:
A. 4
B. 3
C. 6
D. 5
Lời giải:
Câu 3. Hiện tượng gì xảy ra khi cho dung dịch NaOH vào ống nghiệm có chứa dung dịch FeCl2?
A. Xuất hiện màu nâu đỏ
B. Xuất hiện màu trắng xanh
C. Xuất hiện màu nâu đỏ rồi chuyển sang màu trắng xanh
D. Xuất hiện màu trắng xanh rồi chuyển sang màu nâu đỏ
Lời giải:
Câu 4. Hoà tan Fe vào dung dịch AgNO3 dư, dung dịch thu được chứa chất nào sau đây?
A. Fe(NO3)2
B. Fe(NO3)3
C. Fe(NO2)2, Fe(NO3)3, AgNO3
D. Fe(NO3)3, AgNO3
Lời giải:
Câu 5. Sắt tác dụng với khí clo ở nhiệt độ cao tạo thành
A. Sắt(II) clorua.
B. Sắt(III) clorua.
C. Sắt clorua.
D. Sắt(II) clorua và sắt(III) clorua.
Lời giải:
Câu 6. Dung dịch axit clohiđric tác dụng với sắt tạo thành:
A. Sắt (II) clorua và khí hiđrô
B. Sắt (III) clorua và khí hiđrô.
C. Sắt (II) Sunfua và khí hiđrô
D. Sắt (II) clorua và nước
Lời giải:
Câu 7. Cho các chất sau: Fe(OH)3, Fe3O4, FeSO4 và Fe(NO3)2. Số chất trong dãy tác dụng với dung dịch HCl là
A. 4
B. 1
C. 2
D. 3
Lời giải:
