Phản ứng FeSO4 + HNO3 → Fe(NO3)3 + H2SO4 + NO2↑ + H2O
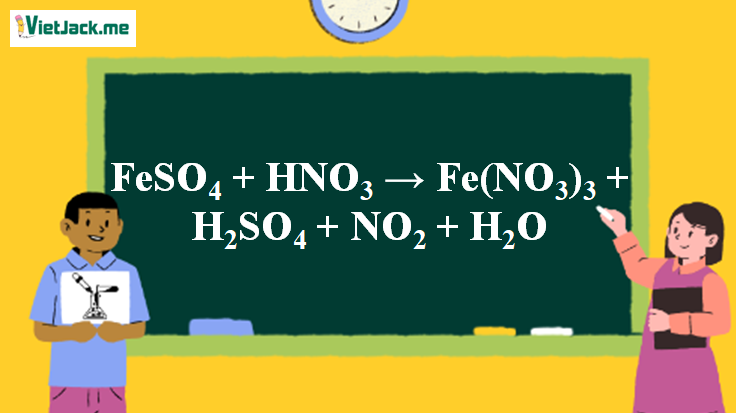
1. Phương trình phản ứng FeSO4 tác dụng HNO3
2. Điều kiện phản ứng FeSO4 ra Fe(NO3)3
Nhiệt độ phòng.
3. Hiện tượng xảy ra khi cho FeSO4 tác dụng với dung dịch HNO3
Xuất hiện khí không màu hóa nâu trong không khí (NO).
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của FeSO4 (Sắt (II) sunfat)
– Trong phản ứng trên FeSO4 là chất khử.
– FeSO4 mang tính khử khi tác dụng với Cl2, axit,..
4.2. Bản chất của HNO3 (Axit nitric)
– Trong phản ứng trên HNO3 là chất oxi hoá.
– HNO3 tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất chưa lên hoá trị cao nhất.
5. Kiến thức về FeSO4
5.1. Tính chất vật lí và nhận biết
– Tính chất vật lý: Có khả năng hút ẩm tốt, thường tồn tại ở trạng thái ngậm nước. Tan tốt trong nước cho dung dịch không màu.
– Nhận biết: Sử dụng dung dịch BaCl2, thấy xuất hiện kết tủa trắng:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
5.2. Tính chất hóa học
– Mang đầy đủ tính chất hóa học của muối.
– Có tính khử và tính oxi hóa:
Tính khử: Fe2+ → Fe3+ + 1e
Tính oxi hóa: Fe2+ + 1e → Fe
a. Tính chất hóa học của muối:
– Tác dụng với dung dịch kiềm:
FeSO4 + KOH → K2SO4 + Fe(OH)2
– Tác dụng với muối:
FeSO4 + BaCl2 → BaSO4 + FeCl2.
b. Tính khử:
FeSO4 + Cl2 → FeCl3 +Fe2(SO4)3
2FeSO4 + 2H2SO4 đặc nóng → Fe2(SO4)3 + SO2 + 2H2O
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
c. Tính oxi hóa:
FeSO4 + Mg → MgSO4 + Fe
5.3. Điều chế
– Cho kim loại Fe dư tác dụng với axit HNO3
3Fe + 8HNO3 → 4H2O + 2NO + 3Fe(NO3)2
6. Tính chất hóa học của HNO3
– Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
– Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
– Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
– Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
– Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
– Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
– Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
– Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
– Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
– Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
7. Bài tập vận dụng liên quan
Câu 1. Cho phương trình phản ứng: aFe + bHNO3 → cFe(NO3)3+ dNO + eH2O
Tỉ lệ a: b là:
A. 2: 3
B. 2: 5
C. 1: 3
D. 1: 4
Lời giải:
Câu 2. Khi đun nóng, phản ứng giữa cặp chất nào sau đây tạo ra ba oxit?
A. Axit nitric đặc và cacbon
B. Axit nitric đặc và đồng
C. Axit nitric đặc và lưu huỳnh
D. Axit nitric đặc và bạc
Lời giải:
Câu 3. Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính khử vừa thể hiện tính Oxi hóa khi tham gia phản ứng?
A. NH3, N2O5, N2, NO2
B. N2, NO, N2O, N2O5
C. NH3, NO, HNO3, N2O5
D. NO2, N2, NO, N2O3
Lời giải:
Câu 4. Hợp chất nào sau đây của nitơ không được tạo ra khi cho HNO3 tác dụng với kim loại?
A. N2O
B. NH4NO3
C. NO2
D. N2O5
Lời giải:
