Phản ứng H2S + KMnO4 → KOH + MnO2 + S + H2O
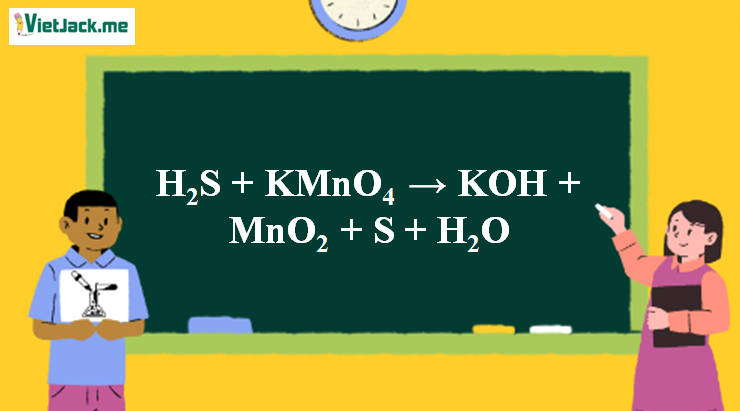
1. Phương trình phản ứng H2S tác dụng với KMnO4
H2S + 2KMnO4 → 2KOH + 2MnO2 + 3S + 2H2O
2. Điều kiện phản ứng xảy ra giữa H2S và KMnO4
Nhiệt độ
3. Tính chất hóa học của H2S
3.1. Tính axit yếu
Hiđro sunfua tan trong nước tạo thành dung dịch axit rất yếu (yếu hơn axit cacbonic), có tên là axit sunfuhiđric (H2S).
Axit sunfuhiđric tác dụng với kiềm tạo nên 2 loại muối: muối trung hòa, như Na2S chứa ion S2- và muối axit như NaHS chứa ion HS−.
H2S + NaOH → NaHS + H2O
H2S + 2NaOH → Na2S + 2H2O
3.2. Tính khử mạnh
Là chất khử mạnh vì trong H2S lưu huỳnh có số oxi hoá thấp nhất (-2).
Khi tham gia phản ứng hóa học, tùy thuộc vào bản chất và nồng độ của chất oxi hóa, nhiệt độ,…mà nguyên tố lưu huỳnh có số oxi hóa −2 (S-2) có thể bị oxi hóa thành (S0), (S+4), (S+6).
Tác dụng với oxi có thể tạo S hoặc SO2 tùy lượng ôxi và cách tiến hành phản ứng.
2H2S + 3O2 dư → 2H2O + 2SO2
2H2S + O2 → 2H2O + 2S
Ở nhiệt độ cao, khí H2S cháy trong không khí với ngọn lửa xanh nhạt, H2S bị oxi hóa thành SO2:
Tác dụng với clo có thể tạo S hay H2SO4 tùy điều kiện phản ứng.
H2S + 4Cl2 + 4H2O → 8HCl + H2SO4
H2S + Cl2 → 2HCl + S (khí clo gặp khí H2S)
4. Tính chất hóa học của KMnO4
4.1. Phản ứng phân hủy bởi nhiệt độ cao
2KMnO4 → K2MnO4 + MnO2 + O2
Khi pha loãng tinh thể pemanganat dưới ánh sáng mặt trời trực tiếp, oxi được giải phóng
4KMnO4 + 2H2O → 4KOH + 4MnO2 + 3O2
4.2. Phản ứng với axit
KMnO4 có thể phản ứng với nhiều axit mạnh như H2SO4, HCl hay HNO3
2KMnO4 + H2SO4 → Mn2O7 + K2SO4 + H2O
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
3K2MnO4 + 4HNO3 → 2KMnO4 + MnO2 + 4KNO3 + 2H2O
4.3. Phản ứng với bazơ
Thuốc tím có thể tác dụng với nhiều dung dịch kiềm hoạt động mạnh như KOH, NaOH
4KMnO4 + 4KOH → 4K2MnO4 + 2H2O + O2
4KMnO4 + 4NaOH + → 2K2MnO4 + 2Na2MnO4 + 2H2O + O2
4.4. Tính chất oxy hóa của KMnO4
– Vì thuốc tím là chất oxy hóa mạnh nên có thể phản ứng với nhiều loại dung dịch và cho ra nhiều sản phẩm khác nhau.
– Trong môi trường axit, mangan bị khử thành Mn2+
2KMnO4 + 5Na2SO3 + 3H2SO4 ? 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
– Trong môi trường trung tính, tạo thành MnO2 có cặn màu nâu.
2KMnO4 + 3K2SO3 + H2O ? 3K2SO4 + 2MnO2 + 2KOH
– Trong môi trường kiềm, bị khử thành MnO42-
2KMnO4 + Na2SO3 + 2KOH ? 2K2MnO4 + Na2SO4 + H2O
4.5. Phản ứng với các hợp chất hữu cơ
– Phản ứng với etanol:
4KMnO4 + 3C2H5OH → 3CH3COOH + 4MnO2 + 4KOH + H2O
– Phản ứng với axetilen trong môi trường kiềm:
C2H2 + 10KMnO4 + 14KOH → 10K2MnO4 + 2K2CO3 + 8H2O
– Phản ứng với axetilen trong môi trường trung tính:
3C2H2 + 10KMnO4 + 2KOH → 6K2CO3 + 10MnO2 + 4H2O
– Phản ứng với axetilen trong môi trường axit:
C2H2 + 2KMnO4 + 3H2SO4 → 2CO2 + 2MnSO4 + K2SO4 + 4H2O
– KMnO4 phản ứng với Ethylene trong môi trường kiềm:
12KMnO4 + C2H4 + 16KOH → 12K2MnO4 + 2K2CO3 + 10H2O
– KMnO4 phản ứng với Ethylene trong môi trường trung tính:
4KMnO4 + C2H4 → 2K2CO3 + 4MnO2 + 2H2O
– Phản ứng với glixerol:
14KMnO4 + 4C3H8O3 → 7K2CO3 + 7Mn2O3 + 5CO2 + 16H2O
4.6. Các phản ứng khác của KMnO4
– Thuốc tím tác dụng với H2O2
2KMnO4 + 3H2O2 → 2KOH + 2MnO2 + 3O2 + 2H2O
– KMnO4 tác dụng với H2S
2KMnO4 + 3H2SO4 + 5H2S → 5S + 8H2O + K2SO4 + 2Mn
5. Bài tập vận dụng
Câu 1. Dẫn khí H2S vào dung dịch KMnO4 và H2SO4 loãng, hiện tượng quan sát được là:
A. Dung dịch không màu chuyển sang màu tím
B. Dung dịch màu tím bị vẩn đục màu vàng
C. Màu tím của dung dịch KMnO4 chuyển sang màu vàng
D. Màu tím của dung dịch KMnO4 chuyển sang không màu và có vẩn đục màu vàng
Lời giải:
Đáp án: D
Giải thích:
Dẫn khí H2S vào dung dịch KMnO4 và H2SO4 loãng, màu tím của dung dịch KMnO4 chuyển sang không màu và có vẩn đục màu vàng
5H2S + 2KMnO4 + 3H2SO4 → 8H2O + 5S + 2MnSO4 + K2SO4
Câu 2. Tính chất nào dưới đây là tính chất đặc trưng của khí hiđro sunfua?
A. Là chất khí không màu.
B. Là chất khí độc.
C. Là chất khí có mùi trứng thối.
D. Cả 3 phương án trên đều sai.
Lời giải:
Đáp án: D
Giải thích:
Câu 3. Trong phương trình H2S + O2 → H2O + 2S thì lưu huỳnh thể hiện tính gì?
A. Khử mạnh.
B. Oxi hóa mạnh.
C. Tính axit mạnh .
D. Tính bazo mạnh.
Lời giải:
Đáp án: A
Câu 4. Cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện, chứng tỏ:
A. Có phản ứng oxi hoá – khử xảy ra.
B. Có kết tủa CuS tạo thành, không tan trong axit mạnh.
C. Axit sunfuhiđric mạnh hơn axit sunfuric.
D. Axit sunfuric mạnh hơn axit sunfuhiđric.
Lời giải:
Đáp án: B
Giải thích:
Điều kiện của phản ứng trao đổi là sau phản ứng sinh ra chất khí hoặc chất kết tủa hoặc chất điện li yếu
Cần thuộc tính chất hóa học của muối sunfua không tan trong axit mạnh
H2S + CuSO4 → CuS↓ (kết tủa đen) + H2SO4
=> Có kết tủa CuS tạo thành, không tan trong axit mạnh.
Câu 5. Cho 0,1 mol khí H2S tác dụng vừa đủ với Pb(NO3)2 tính khối lượng kết tủa thu được.
A. 23,9 gam.
B. 10,2 gam.
C. 5,9 gam.
D. 6 gam.
Lời giải:
Đáp án: A
Câu 6. Trong các câu sau đây, câu nào sai?
A. Dẫn khí H2S vào dung dịch KMnO4 và H2SO4 loãng, dung dịch KMnO4chuyển sang không màu và có vẩn đục màu vàng
B. Sục SO2vào dung dịch K2CO3tạo khí CO2.
C. SO2 vừa có tính oxi hóa, vừa có tính khử.
D. SO2 làm mất màu dung dịch brom.
Lời giải:
Đáp án: B
Giải thích:
Câu sai là: Sục SO2 vào dung dịch K2CO3 tạo khí CO2. SO2 không đẩy được CO2 ra khỏi dung dịch
Xem thêm các phương trình phản ứng hóa học khác:
P + KClO3 → KCl + P2O5
H3PO4 + NaOH → Na3PO4 + H2O
NO2 + O2 + H2O → HNO3
Na + H2O → NaOH + H2
Na2O + H2O → NaOH
