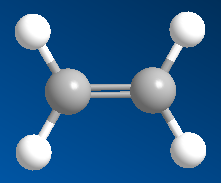
- Anken cấu tạo có một liên kết đôi gồm một liên kết (sigma) bền vững và một liên kết (pi) kém bền.
- Anken là hiđrocacbon không no mạch hở, trong phân tử có một liên kết đôi C=C.
1.1.1. Dãy đồng đẳng của anken
- Etilen (C2H4), propilen (C3H6),butilen (C4H10) … có tính chất tương tự etilen lập thành dãy đồng đẳng gọi là dãy đồng đẳng của etilen.
- Công thức phân tử chung CnH2n ( n ≥ 2 )
(Từ C2H4, theo khái niệm đồng đẳng: C2H4(CH2)k → C2+kH4+2k đặt 2 + k = n thì công thức phân tử chung của anken là: CnH2n ((n ge 2))
1.1.2. Đồng phân
a) Đồng phân cấu tạo
- Đồng phân vị trí liên kết đôi
CH2=CH-CH2-CH3
CH3-CH=CH-CH3
- Đồng phân mạch cacbon
b) Đồng phân hình học
Điều kiện: (begin{array}{l} {R_1} ne {R_2}\ {R_3} ne {R_4} end{array})
- Đồng phân cis: Khi mạch chính nằm cùng một phía của liên kết C=C.
- Đồng phân trans: Khi mạch chính nằm ở phía khác nhau của liên kết C=C.
;
1.1.3. Danh pháp
a) Tên thông thường
Tên anken = Tên ankan đổi đuôi an thành ilen
Ví dụ :
CH2=CH2: Etilen
CH2=CH-CH3 Propilen
b) Tên thay thế
Tên anken = Tên ankan đổi đuôi an thành en
*Quy tắc:
- Chọn mạch chính là mạch C dài nhất có chứa liên kết đôi.
- Đánh số C mạch chính từ phía gần liên kết đôi nhất.
- Gọi tên theo thứ tự:
Số chỉ vị trí nhánh + tên nhánh + tên C mạch chính + số chỉ liên kết đôi + en
*Ví dụ:
CH2=CH2: Eten
CH2=CH-CH3 : Propen
CH2=CH-CH2-CH3 But-1-en
CH3-CH=CH-CH3 But-2-en
- Từ C2H4 → C4H8: là chất khí
- Từ C5H10 trở đi là chất lỏng hoặc chất rắn.
- Nhiệt độ nóng chảy , nhiệt độ sôi và khối lượng riêng tăng dần theo chiều tăng của phân tử khối.
- Các anken đều nhẹ hơn nước và không tan trong nước
Hình 1: Mô hình phân tử etilen
-
Đặc điểm cấu tạo của anken có một liên kết đôi C=C (gồm một liên kết (sigma) bền vững và một liên kết (pi) kém bền)
-
Dự đoán tính chất hóa học của anken
-
Liên kết đôi là trung tâm phản ứng.
-
Phản ứng phá vỡ liên kết (pi) kém bền.
-
1.3.1. Phản ứng cộng
Phản ứng cộng là phản ứng trong đó phân tử hợp chất hữu cơ kết hợp với phân tử khác tạo thành phân tử hợp chất mới.
a) Cộng hiđrô (Phản ứng hiđro hoá)
CnH2n + H2 CnH2n+2
CH2=CH2 + H2 CH3-CH3
CH3-CH=CH2 + H2 CH3-CH2-CH3
b) Cộng halogen (Phản ứng halogen hoá)
CnH2n + Br2 → CnH2nBr2
Anken làm mất màu của dung dịch brom → Phản ứng này dùng để nhận biết anken.
Video 1: Etilen tác dụng với dung dịch Brom
CH2=CH2 + Br2 → BrCH2 – CH2Br
(Màu nâu đỏ) 1,2-đibrometan
(Không màu)
c) Cộng HX (X là OH, Cl, Br,…)
CH2=CH2 + HBr → CH3-CH2Br
CH2=CH2 + H-OH CH3-CH2OH
Qui tắc Mac-côp-nhi-côp:
Trong phản ứng cộng HX vào liên kết đôi,nguyên tử H (hay phần mang điện tích dương) chủ yếu cộng vào nguyên tử cacbon bậc thấp hơn (có nhiều H hơn), còn nguyên tử hay nhóm nguyên tử X (phần mang điện tích âm) cộng vào nguyên tử cacbon bậc cao hơn (có ít H hơn).
1.3.2. Phản ứng trùng hợp
nCH2=CH2 [- CH2-CH2 -]n
- Phản ứng trùng hợp là quá trình kết hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành những phân tử rất lớn gọi là polime .
- Chất đầu (CH2=CH2) gọi là monome, -CH2-CH2- gọi là mắc xích của polime, n là hệ số trùng hợp.
- tên polime = poli + tên monome
1.3.3. Phản ứng oxi hóa
a) Oxi hoá hoàn toàn
Phản ứng đốt cháy anken: số mol CO2 = số mol H2O
b) Oxi hoá không hoàn toàn
Anken làm mất màu dd KMnO4 → Dùng để nhận biết anken
1.4.1. Trong phòng thí nghiệm
Etilen được điều chế từ ancol etylic theo phương trình:
C2H5OH 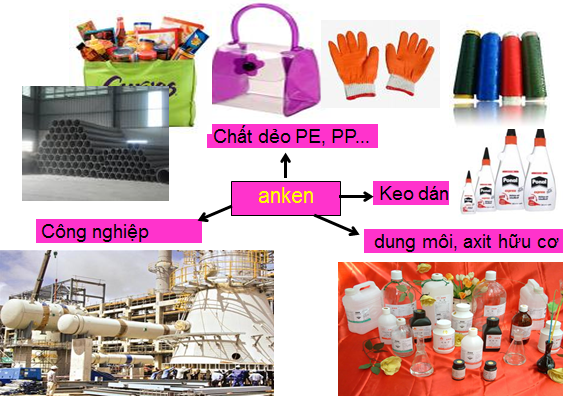
Video 2: Điều chế etilen từ ancol etylic
1.4.2. Trong công nghiệp
Anken được điều chế từ ankan
CnH2n+2 CnH2n + H2
- Nguyên liệu cho tổng hợp hóa học: keo dán, axit hữu cơ
- Tổng hợp polime: PVC, PVA, PE …
- Làm dung môi …
Hình 2: Ứng dụng của anken