Lời giải bài tập Hóa học lớp 10 Bài 20: Ôn tập chương 6 sách Kết nối tri thức ngắn gọn, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi Hóa học 10 Bài 20 từ đó học tốt môn Hóa 10.
Giải bài tập Hóa học lớp 10 Bài 20: Ôn tập chương 6
I. Hệ thống hóa kiến thức
Giải hóa học 10 trang 102 Kết nối tri thức
II. Luyện tập
Câu hỏi 1 trang 102 Hóa học 10: Hãy cho biết trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc độ chậm?
(a) Đốt cháy nhiên liệu.
(b) Sắt bị gỉ.
(c) Trung hòa acid – base
Phương pháp giải:
Phản ứng xảy ra nhanh hay chậm phụ thuộc vào nhiều yếu tố: trạng thái tồn tại, nồng độ, nhiệt độ, áp suất,…
Lời giải:
(a) Phản ứng xảy ra nhanh.
(b) Phản ứng xảy ra chậm
(c) Phản ứng xảy ra nhanh.
Câu hỏi 2 trang 102 Hóa học 10: Cho khoảng 2 g zinc (kẽm) dạng hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây (các điều kiện khác giữ nguyên) thì tốc độ phản ứng sẽ thay đổi thế nào (tăng lên, giảm xuống hay không đổi)?
(a) Thay kẽm hạt bằng kẽm bột cùng khối lượng và khuấy đều.
(b) Thay dung dịch H2SO4 2 M bằng dung dịch H2SO4 1M có cùng thể tích.
(c) Thực hiện phản ứng ở nhiệt độ cao hơn (khoảng 50oC).
Phương pháp giải:
– Tốc độ phản ứng tăng khi: tăng diện tích tiếp xúc, tăng nồng độ, tăng nhiệt độ…
Lời giải:
(a) Kẽm được dùng dưới dạng bột nên tăng diện tích tiếp xúc
=> Tốc độ phản ứng tăng lên
(b) Dung dịch H2SO4 1M có nồng độ giảm so với ban đầu H2SO4 2M
=> Tốc độ phản ứng giảm xuống
(c) Tăng nhiệt độ của phản ứng
=> Tốc độ phản ứng tăng lên
Câu hỏi 3 trang 102 Hóa học 10: Hydrogen peroxide phân hủy theo phản ứng: 2H2O2 → 2H2O + O2.
Đo thể tích oxygen thu được theo thời gian, kết quả được ghi trong bảng sau:
Lời giải:
a)
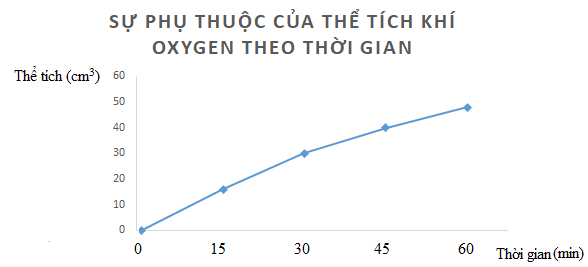
b)

Câu hỏi 4 trang 102 Hóa học 10: Hãy thiết kế một thí nghiệm để chứng minh ảnh hưởng của nhiệt độ đến tốc độ phản ứng của zinc và sulfuric acid loãng.
Phương pháp giải:
Nhiệt độ tăng lên, tốc độ phản ứng cũng tăng.
Lời giải:
Chuẩn bị: 2 ống nghiệm, 2 kẹp gỗ, 1 đèn cồn, 4 gam Zn hạt và dung dịch H2SO4 loãng 0,1 M.
Tiến hành:
– Cho vào 2 ống nghiệm, mỗi ống 5mL H2SO4 0,1M
– Cho cùng một lượng (2 gam) zinc dạng viên vào ống nghiệm (1) và (2).
– Đun nóng 1 ống nghiệm
Kết quả: Ống nghiệm dược đun nóng sẽ thoát khí nhanh hơn.
Câu hỏi 5 trang 102 Hóa học 10: Một phản ứng ở 45oC có tốc độ là 0,068 mol/(L.min). Hỏi phải giảm xuống nhiệt độ bao nhiêu để tốc độ phản ứng là 0,017 mol/(L.min). Giả sử, trong khoảng nhiệt độ thí nghiệm, hệ số nhiệt độ Van’t Hoff của phản ứng bằng 2.
Phương pháp giải:
γ=vT+10vT
Lời giải:
γ=vT+10vT
=> v2v1=γT2−T110
Ta có: v1 = 0,068 v2 = 0,017 T1 = 45oC
=> 0,0170,068=2x−4510
=> x = 25oC
Bài giảng Hóa học 10 Bài 20: Ôn tập chương 6 – Kết nối tri thức
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 19: Tốc độ phản ứng
Bài 20: Ôn tập chương 6
Bài 21: Nhóm halogen
Bài 22: Hydrogen halide. Muối halide
Bài 23: Ôn tập chương 7

