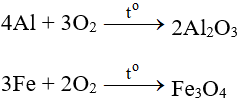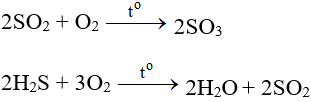N2 + O2 2NO
2. Điều kiện phản ứng Nitơ tác dụng với oxi tạo nitơ monooxit
Ở nhiệt độ khoảng 3000oC (hoặc nhiệt độ của lò hồ quang điện).
3. Bản chất của phản ứng
Ở nhiệt độ khoảng 3000oC (hoặc nhiệt độ của lò hồ quang điện), nito kết hợp trực tiếp với oxi tạo ra khí nitơ monooxit
Ở điều kiện thường, khí NO không màu kết hợp ngay với oxi của không khí tạo ra khí nito đioxxit NO2 có màu nâu đỏ.
2NO + O2 → 2NO2
4. Tính chất hoá học của N2
– Nitơ có các số oxi hoá: -3, 0, +1, +2, +3, +4, +5.
– N2 có số oxi hoá 0 nên vừa thể hiện tính oxi hoá và tính khử.
– Nitơ có EN N = 946 kJ/mol, ở nhiệt độ thường nitơ khá trơ về mặt hóa học nhưng ở nhiệt độ cao hoạt động hơn.
– Nitơ thể hiện tính oxi hóa và tính khử, tính oxi hóa đặc trưng hơn.
4.1. Tính oxi hoá
Phân tử nitơ có liên kết ba rất bền, nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường.
a. Tác dụng với hidro
Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hidro tạo amoniac.
b. Tác dụng với kim loại
– Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua: 6Li + N2 → 2Li3N.
– Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại: 3Mg + N2 → Mg3N2 (magie nitrua).
Lưu ý: Các nitrua dễ bị thủy phân tạo NH3.
Nitơ thể hiện tính oxi hoá khi tác dụng với nguyên tố có độ âm điện nhỏ hơn.
4.2. Tính khử
– Ở nhiệt độ cao (3000 ºC) Nitơ phản ứng với oxi tạo nitơ monoxit.
– Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ.
Nitơ thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn.
– Các oxit khác của nitơ: N2O, N2O3, N2O5 không điều chế được trực tiếp từ nitơ và oxi.
Ghi nhớ: Nitơ thể hiện tính khử khi tác dụng với các nguyên tố có độ âm điện lớn hơn. Thể hiện tính oxi hóa khi tác dụng với các nguyên tố có độ âm điện lớn hơn.
5. Tính chất hóa học của O2
– Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
– Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
– Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, …) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
5.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
5.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
5.3. Tác dụng với hợp chất
– Tác dụng với các chất có tính khử:
– Tác dụng với các chất hữu cơ:
6. Bài tập vận dụng liên quan
Câu 1. Nitơ thể hiện tính khử trong phản ứng với chất nào sau đây?
A. H2.
B. O2.
C. Ca.
D. Al.
Lời giải:
Câu 2. Khi có tia lửa điện hoặc ở nhiệt độ cao, nitơ tác dụng trực tiếp với oxi tạo ra hợp chất A. Công thức của A là
A. N2O.
B. NO2.
C. NO.
D. N2O5.
Lời giải:
Câu 3. Để điều chế khí nito trong phòng thí nghiệm người ta sử dụng cách nào sau đây:
A. nhiệt phân NaNO2
B. Đun nóng dung dịch NH4NO2
C. thủy phân Mg3N2
D. phân hủy khí NH3
Lời giải:
Câu 4. Ứng dụng nào sau đây không phải của nitơ?
A. Làm môi trường trơ trong một số ngành công nghiệp
B. Bảo quản máu và các mẫu vật sinh học
C. Tổng hợp ra khí amoniac từ đó sản xuất ra axit nitric
D. Sản xuất phân lân
Lời giải: