Phản ứng NaHCO3 + H2SO4 → Na2SO4 + CO2 + H2O
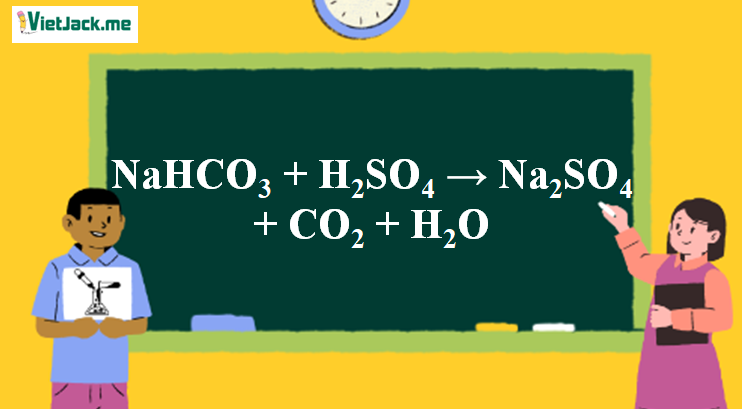
1. Phương trình phản ứng phân tử NaHCO3 + H2SO4
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
2. Điều kiện phản ứng NaHCO3 ra Na2SO4
Nhiệt độ thường
3. Phương trình ion rút gọn NaHCO3 + H2SO4
2NaHCO3 + H2SO4 → Na2SO4 + 2CO2 + 2H2O
Phương trình ion rút gọn:
HCO3- + H+ → CO2 + H2O
4. Hiện tượng phản ứng khi cho dung dịch NaHCO3 tác dụng H2SO4
Cho dung dịch NaHCO3 tác dụng H2SO4 thấy xuất hiện khí không màu thoát ra.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của NaHCO3 (Natri hidrocacbonat)
NaHCO3 là một muối axit nhưng thể hiện tính axit yếu tác dụng với axit mạnh tạo muối mới và nước và đồng thời cũng giải phóng khí CO2.
5.2. Bản chất của H2SO4 (Axit sunfuric)
H2SO4 là một axit mạnh tác dụng được với muối.
6. Tính chất hóa học của NaHCO3 (Natri hidrocacbonat)
NaHCO3 là chất rắn màu trắng, ít tan trong nước dễ bị nhiệt phân hủy tạo ra Na2CO3 và khí CO2.
6.1. Nhiệt phân tạo thành muối và giải phóng CO2
2NaHCO3 → Na2CO3 +CO2↑ + H2O
6.2. Thủy phân tạo thành môi trường Bazơ yếu
NaHCO3 + H2O → NaOH + H2CO3
6.3. Tác dụng với axit mạnh tạo thành muối và nước
Tác dụng với Axit Sunfuric:
2NaHCO3 + H2SO4 → Na2SO4+ 2H2O + 2CO2
Tác dụng với axit Clohiric:
NaHCO3 + HCl → NaCl + H2O + CO2
6.4. Tác dụng với bazơ tạo thành muối mới và bazơ mới
Tác dụng với Ca(OH)2:
NaHCO3+ Ca(OH)2 → CaCO3 + NaOH + H2O.
Một trường hợp khác có thể tạo thành 2 muối mới với phương trình phản ứng:
2NaHCO3 + Ca(OH)2 → CaCO3 + Na2CO3 + 2H2O.
Tác dụng với NaOH:
NaHCO3 + NaOH → H2O + Na2CO3
7. Tính chất hoá học của H2SO4
7.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
7.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
8. Bài tập vận dụng
Câu 1. Chất nào sau đây lưỡng tính?
A. Fe(OH)3.
B. Mg(OH)2.
C. NaCl.
D. NaHCO3.
Lời giải:
Đáp án: D
Câu 2. Dung dịch chất nào sau đây không làm đổi màu quỳ tím?
A. HCl.
B. K2SO4.
C. Ba(OH)2.
D. HClO4.
Lời giải:
Đáp án: B
Câu 3. Muối nào sau đây là muối axit?
A. NH4NO3.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COONa.
Lời giải:
Đáp án: C
Câu 4. Chất nào sau đây không có tính lưỡng tính?
A. K2CO3.
B. (NH4)2CO3.
C. Al(OH)3.
D. NaHCO3.
Lời giải:
Đáp án: A
Câu 5. Cho 19,2 gam hỗn hợp muối cacbonat của kim loại hóa trị I và muối cacbonat của kim loại hóa trị II tác dụng với dung dịch HCl dư, thu được 4,48 lít một chất khí (đktc). Tính khối lượng muối tạo ra trong dung dịch.
A. 21,4
B. 42,8
C. 32,1
D. 20,4
Lời giải:
Đáp án: A
Giải thích:
Gọi công thức hai muối cacbonat là M2CO3 và M’CO3
M2CO3 + 2HCl → 2MCl + CO2 + H2O
M’CO3 + 2HCl → M’Cl2 + CO2 + H2O
Áp dụng phương pháp tăng giảm khối lượng:
1 mol muối cacbonnat tạo thành muối clorua ⇒ khối lượng tăng.
35,5 .2 – 60 = 11 (gam) ⇒ nCO2 = nmuối cacbonat = 0,2(mol)
⇒ mmuối clorua = mmuối cacbonlat + 0,2.11 = 19,2 + 2,2 = 21,4 (gam)
Câu 6. Dung dịch X chứa hỗn hợp gồm Na2CO31,5M, KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là:
A. 4,48
B. 3,36
C. 2,24
D. 1,12
Lời giải:
Đáp án: D
Giải thích:
nCO32- = 0,15 mol ; nHCO3- = 0,1 mol ; nH+ = 0,2 mol
CO32- + H+ → HCO3- (1)
0,15 0,15
HCO3- + H+ → CO2 + H2O (2)
0,05
Nhỏ từ từ từng giọt HCl nên phản ứng xảy ra theo trình tự
Sau phản ứng (1) nH+ còn: 0,2 – 0,15 = 0,05 (mol) nên HCO3- dư.
⇒ VCO2 = 0,05.22,4 = 1,12 lít
Câu 7. Hấp thụ hoàn toàn 0,672lit khí CO2 (đktc) vào 1 lít dd gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là:A. 2,00
B. 0,75
C. 1,25
D. 1,00
Lời giải:
Đáp án: C
Giải thích:
nOH- = nNaOH+ 2nCa(OH)2 = 0,05 mol
nCO2 = 0,672/22,4 = 0,03 mol
CO2+ OH- → HCO3-
0,03
HCO3- + OH- → CO32- + H2O
0,02
Ca2+ + CO32- → CaCO3
0,0125
⇒ x = 0,0125.100 = 1,25 g
Câu 8. Nung 65,1 gam muối cacbonat của kim loại M hóa trị II thu được V lít CO2. Sục CO2 thu được vào 500 ml Ba(OH)2 0,95M được 34,475 gam kết tủa. Tìm kim loại M?
A. Mg
B. Ba
C. Ca
D. Na
Lời giải:
Đáp án: A
Giải thích:
Phương trình phản ứng tổng quát
MCO3 → MO + CO2
nBa(OH)2 = 0,95.0,5 = 0,475 mol
Khi sục CO2 vào Ba(OH)2 kết tủa thu được là BaCO3
nBaCO3= 34,475/197 = 0,175 mol
nBaCO3 = 0,175 < nBa(OH)2
TH1 chỉ tạo thành muối cacbonat → nCO2 = nBaCO3 = 0,175 mol
→ nMCO3 = 0,175 mol → MMCO3 = 65,1/0,175 = 372
→ không có kim loại nào phù hợp
TH2 tạo thành hai muối BaCO3: 0,175 mol và Ba(HCO3)2: y mol
Bảo toàn nguyên tố Ba: 0,175 + y = 0,475 → y =0,3
nCO2 = nBaCO3+ 2nBa(HCO3)2 = 0,175 + 2.0,3 = 0,775 mol
nMCO3 = nCO2 = 0,775 mol → MMCO3 = 65,1/0,775 = 84 → M = 24 → M: Mg
Câu 9. Nung 14,2 gam hỗn hợp 2 muối cacbonat của 2 kim loại hóa trị 2 được 7,6 gam chất rắn và khí X. Dẫn toàn bộ lượng khí X vào 100 ml dung dịch KOH 1M thì khối lượng muối thu được sau phản ứng là:
A. 10 gam
B. 20 gam
C. 15 gam
D. 25 gam
Lời giải:
Đáp án: A
Giải thích:

